ISSN 0374-647 X
BOL. A. N. DE MEDICINA 2002; 80(1):
INFECCIONES EMERGENTES EN ARGENTINA
DRAS. ZULMA ORTIZ**, ELENA
PEDRONI***
Y ACAD. CHRISTIANE DOSNE PASQUALINI****
RESUMEN
El objetivo de esta revisión
es describir la situación de las enfermedades infecciosas emergentes
consideradas más relevantes. Argentina tiene la incidencia más
alta en el mundo de Síndrome Urémico Hemolítico
primera causa pediátrica de insuficiencia renal aguda y segunda
de insuficiencia renal crónica responsable del 30% de todos los
trasplantes renales en niños y adultos. Hantavirus: un total
de 353 casos fueron notificados entre 1997 y 2001. Estudios filogenéticos
confirman al virus ANDES y existe evidencia de la transmisión
persona a persona. El vector del Dengue fue reintroducido en 1963, y
hoy es un serio problema. En los años 1998 y 2000, ocurrieron
dos brotes en Salta y Paraguay debido a DEN-2 y DEN-1 respectivamente.
El Ministerio de Salud de la Nación ha implementado un plan para
el monitoreo, prevención y control. Fiebre Hemorrágica
Argentina es una enfermedad viral aguda grave causada por el arena virus
Junín. La vacuna Candid 1 es altamente efectiva, con una protección
por anticuerpos de 9 años, en aproximadamente el 90% de la población
vacunada con una sola dosis. Hasta septiembre de 2001, se notificaron
20.713 casos de SIDA: la tasa más alta de transmisión
corresponde a usuarios de drogas intravenosas (UDI), (38%), la transmisión
en hombres y mujeres tiende a disminuir, tanto en homosexuales como
en usuarios de drogas intravenosas (UDI), mientras que aumenta en los
heterosexuales. La Tuberculosis ha experimentado un descenso continuo
desde 1982; se advierte sobre la necesidad de fortalecer las acciones
de control. La crisis económica ha puesto en riesgo este aspecto
del programa. La Leishmaniasis Tegumentaria Americana suma más
de 1.200 casos en el país. El diagnóstico y tratamiento
temprano ha reducido significativamente la incidencia de la enfermedad.
Conclusiones: la crisis económica reciente ha puesto en evidencia
la necesidad de fortalecer nuestro sistema de vigilancia. Las enfermedades
emergentes deben ser entendidas en un contexto de emergencia sanitaria,
en el que la desnutrición, la pobreza, el desempleo y las iniquidades
favorecen su aparición y propagación. Hoy el esfuerzo
debe ser mayor y convocar a todos los sectores para poder controlar
la emergencia.
Palabras clave: enfermedades emergentes, síndrome urémico hemolítico, hanta, dengue, fiebre hemorrágica argentina, HIV-SIDA, tuberculosis, leishmaniasis.
EMERGING INFECTIONS IN ARGENTINA
This paper describes the situation of the 7 most relevant emerging infections. Hemolytic Uremic Syndrome: Argentina has the highest incidence of HUS estimated at 8.6/100,000 children under 5 years. Hantavirus: A total of 353 cases were notified between 1997 and 2001. Phylogenetic analysis confirmed infection with ANDES virus. Unexpectedly, there is evidence of person-to-person transmission of the virus. Dengue: After its eradication in 1963, this vector was reintroduced and now constitutes a major problem. In 1998 and 2000, dengue outbreaks occurred in Salta and Paraguay due to DEN-2 and DEN-1, respectively. A national plan to control the disease has been launched. Argentine Hemorrhagic Fever: This rodent-transmitted endemic disease is caused by Junin virus which was isolated in 1958. The efficacy (95.5%) of Candid 1 elicits high levels of protective antibodies of 9 years duration. HIV/AIDS: Up to September 2001, a total of 20,713 AIDS cases had been notified, 72% being still alive. The highest HIV transmission rate of 38% corresponded to the IDU group. Lately, in men, transmission trends have decreased both in the homosexual and intravenous drugs users (IDU) groups while it has been increasing in heterosexuals especially since 1997. In women, there has also been a decrease in the IDU group and an increase in heterosexual transmission, often with an IDU partner. Tuberculosis: although it has been decreased since 1982; there is still needs to strenght the national program. Leishmaniosis: a total of 1,200 cases have been notified, mainly in adult males with forest related activities. Conclusion: Today the burden of emerging infections constitutes a serious public health problem. There is need of an even stronger surveillance system, in this sense, efforts are being made by Vigi+A within the Ministry of Public Health and we are convinced that any arising emergency will be controlled in spite of economic crises.
Key words: emerging diseases, hemolytic uremic syndrome, hanta, dengue, argentine hemorrhagic fever, HIV-AIDS, tuberculosis, leishmaniosis,
INTRODUCCIÓN
Las enfermedades infecciosas emergentes y reemergentes en la Argentina,
ponen a la salud pública en serio riesgo de padecer enfermedades
desconocidas o bien reactivar algunas que ya habían sido controladas,
esto incluye enfermedades endémicas con patrones regionales característicos,
infecciones zoonóticas, virosis e infecciones inmunoprevenibles.
Las infecciones emergentes han sido definidas como "enfermedades
de origen infeccioso cuya incidencia en humanos se ha incrementado en
las últimas dos décadas o tienden a incrementarse en el
futuro cercano". La Organización Mundial de la Salud (OMS)
ha expresado que las enfermedades infecciosas emergentes "representan
un riesgo global que requiere de la coordinación mundial para
su respuesta"1.
En Argentina, desde 1960 existe la Ley 15.465 en la que se declara obligatoria,
en todo el territorio de la Nación, la notificación de
los casos de enfermedades infecciosas. Desde entonces, el MSN ha realizado
grandes esfuerzos para fortalecer el Sistema Nacional de Vigilancia
Epidemiológica (SI.NA.VE.), el que a partir de 1979 modifica
la nómina y agrupamiento de enfermedades de notificación
obligatoria a través del Decreto 2.771/79.
A comienzos de 2001 el MSN implementó un Programa Nacional de
Vigilancia de la Salud y Control de Enfermedades2 (Vigi+A). Este Programa
tiene como objetivos: a) fortalecer y modernizar el SI.NA.VE.; b) fortalecer
los Programas Nacionales de Control de Dengue, Tuberculosis e Infección
Nosocomial y, c) fomentar la participación social en los procesos
de vigilancia en salud y de control y prevención de las enfermedades.
El objetivo de esta revisión es describir la situación de las enfermedades infecciosas emergentes consideradas, al momento, como más relevantes para nuestro país (Tabla 1): Síndrome urémico hemolítico, hantavirus, dengue, fiebre hemorrágica Argentina, HIV/SIDA, tuberculosis y leishmaniasis.
La Academia Nacional de Medicina de Buenos Aires organizó en los últimos años 8 simposios, 3 de los cuales cubrieron aspectos de enfermedades emergentes: en 1998, "SIDA y el desafío de las enfermedades emergentes"3 con la coordinación de Mercedes Weissenbacher y la participación de UNAIDS/OPS/OMS; en 1999; "Problemática de la enfermedad de Chagas"4, bajo la coordinación de Álvaro Moncayo de la OMS y Elsa Segura de ANLIS; en 2001, "Síndrome Urémico Hemolítico"5 en memoria de Carlos Gianantonio, un prominente miembro de nuestra Academia.
SÍNDROME URÉMICO
HEMOLÍTICO (SUH)
Argentina tiene la incidencia más alta en el mundo de SUH. Si
bien la enfermedad fue descripta por Conrad von Gasser en 1955, Gianantonio,
por ese entonces, diagnosticó el primer caso en Argentina y rápidamente
implementó la diálisis intraperitoneal en los pacientes
pediátricos, lo cual disminuyó significativamente el daño
renal y la mortalidad4, 6. En 1982, Karmali demostró que la toxina
Shiga producida por la Escherichia coli (TSEC) era la causa de la enfermedad4,
7. Los avances más recientes fueron en el diagnóstico,
la vigilancia y control así como investigaciones para determinar
su patogénesis4, 8.
En nuestro país, el SUH es la primera causa pediátrica
de insuficiencia renal aguda y la segunda de insuficiencia renal crónica
responsable del 30% de todos los trasplantes renales en niños
y adultos. La tasa de incidencia ha sido estimada en 8.6/100.000 en
niños menores de 5 años, tres veces superior a la de Estados
Unidos, Canadá y Chile, y dos veces superior a la de Uruguay4.
La TSEC ha sido aislada de la carne vacuna y sus derivados. Argentina
tiene niveles de consumo de carne per capita muy elevados y los niños
comienzan a comer carne a edad temprana. Existe sospecha de asociación
entre el consumo de carne mal cocida e infección por TSEC, pero
aún requiere de confirmación. En el año 2000 se
registraron 290 casos (Tabla 2). Recientemente, se han implementado
unidades centinelas en dos hospitales bajo la coordinación de
la Dra. Marta Rivas del MSN-ANLIS, con la colaboración de la
OPS y CDC. La implementación de estas unidades permitirá
obtener datos de la enfermedad que ayudarán a establecer el origen
de la infección en chicos. Investigadores del Departamento de
Inmunología, del Instituto de Investigaciones Hematológicas
ha desarrollado un modelo experimental del SUH en ratón que ha
sido capaz de demostrar que la inoculación de toxina Shiga gatilla
una interacción compleja entre neutrófilos y plaquetas
activadas que lleva al daño endotelial responsable de la lesión
renal4, 9.
HANTAVIRUS
Los virus Hanta (género de la familia Bunyaviridae) infectan
roedores de todo el mundo, y algunas especies infectan a los seres humanos
con diversa intensidad. Su efecto primario actúa en los endotelios
con 2 manifestaciones principales: fiebre hemorrágica con síndrome
renal y un síndrome pulmonar. Al final de los '80, se reportó
la existencia de hantavirus en Argentina10, 11; sin embargo el primer
caso universal de síndrome pulmonar por virus hanta (SPVH) fue
caracterizado en 199512 y desde entonces es una enfermedad sujeta a
vigilancia en Argentina, con el mayor número de casos notificados
en América del Sur13. Hasta el momento no se han registrado casos
de Fiebre Hemorrágica con Síndrome Renal (FHSR); todas
las notificaciones han correspondido a SPVH14. Recientemente, se ha
confirmado la transmisión de persona a persona15, 16. Se han
descripto siete genotipos virales, siendo sólo cuatro los asociados
a enfermedad humana: el de Orán en el norte, Lechiguana, Hu39694
en el centro y Andes en el sur. Respecto a la distribución geográfica
se han identificado tres zonas: Sur (Neuquén, Río Negro
y Chubut), Centro (Buenos Aires, Córdoba, Santa fe y Entre Ríos)
y Norte (Salta, Jujuy y Formosa). Estas zonas muestran condiciones favorables
ecológicas para la convivencia y supervivencia de roedores. Sin
embargo, se piensa que la extensión geográfica podría
ser mayor, y la falta de notificación estaría dada por
la presencia de formas leves y por problemas de enfoque diagnóstico.
Entre 1997 y 2001, la región sur presentó el número menor de casos notificados, que fue de 41; le sigue la región centro con 123 casos y la región norte con 189 casos (Figura 1).
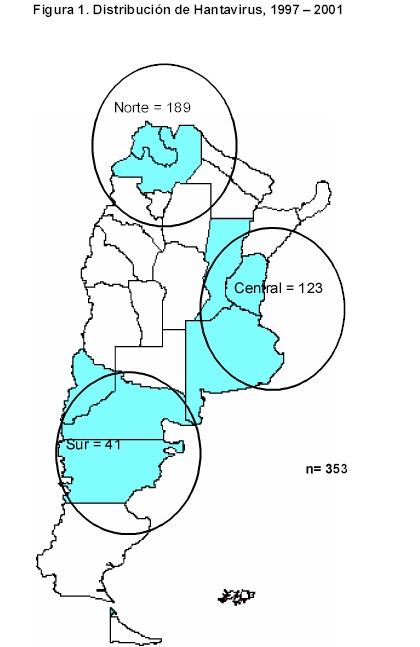
Los análisis filogenéticos realizados en el laboratorio de referencia INEI-ANLIS, mostraron que los casos de SPHV fueron infectados con el virus ANDES17. Factores climáticos y ambientales pueden influenciar en el tamaño de la población y determinar patrones de migración de los huéspedes18. Los casos ocurren entre primavera y otoño, con un pico máximo en el verano. Por tratarse de una enfermedad emergente existe mejor diagnóstico y confirmación por laboratorio; sin embargo, también existen evidencias de un verdadero incremento en la incidencia. En colaboración con el CDC, los laboratorios de ANLIS han realizado varios estudios epidemiológicos, pero aún falta fortalecer la vigilancia de esta enfermedad que cuente con el aporte de los tres componentes para la vigilancia: clínico, epidemiológico y de laboratorio. El MSN a través del programa VIGI+A está colaborando para aumentar las capacidades a través de la capacitación y el financiamiento de investigaciones operativas.
DENGUE
El dengue es uno de los mayores problemas de salud pública, ocasionados
por enfermedades transmisibles, en las Américas. La fiebre del
dengue y, más aún, la fiebre hemorrágica del dengue
constituye una carga económica para las regiones afectadas. Los
gastos directos e indirectos de cada epidemia incluyen la asistencia
médica, a veces con cuidados intensivos; la pérdida en
la producción por ausencia al trabajo de los enfermos adultos
y de los familiares de los niños afectados y, en algunos casos,
otras pérdidas igualmente importantes, como la disminución
del turismo.
Evaluaciones realizadas por la Coordinación Nacional de Vectores muestran que de 854 municipios relevados en Argentina, el 70% resultó infestado por el Aedes aegypti, 23 municipios en 7 provincias están en situación de Muy Alto Riesgo, con antecedentes de brote y factores ambientales favorables para el vector. Esta situación involucra a 2.500.000 personas; mientras que 88 municipios en 9 provincias están en situación de Alto Riesgo, sin antecedentes de brote, pero con factores ambientales favorables para el vector. Ésta es la situación actual de 1.500.000 personas (Figura 2).
Entre 1998 y 2001 se incrementó en 254% el número de municipios positivos, y en las ciudades donde se registraron brotes de dengue el 20% de la población, en promedio, sería susceptible de desarrollar dengue hemorrágico, cuya tasa de letalidad ha sido estimada entre el 5% y el 15%19. Las condiciones de riesgo están dadas por: (a) elevados niveles de infestación del Aedes aegypti; (b) actividad epidémica de dengue y dengue hemorrágico en países fronterizos (Brasil: serotipos DEN1, DEN2 y DEN3, incluyendo ciudades con dengue hemorrágico y Paraguay: DEN1 y DEN2); (c) elevado movimiento poblacional hacia países con transmisión activa; (d) ausencia de actividades sostenidas de control del vector.
En 1998, se reportó un brote de dengue (DEN-2) en Salta20. Dos años más tarde, ocurrió un brote de dengue (DEN-1) en Paraguay el cual derivó en un número inusual de casos en las provincias de Misiones y Formosa21 (Tabla 3). Entre los países del MERCOSUR, el caso más grave es el de Brasil, donde se registró aproximadamente el 63% de los 375.000 casos notificados en América durante 2000, con una preocupante velocidad de crecimiento de la epidemia. En lo que va de 2002 Brasil, y particularmente Río de Janeiro, soporta una creciente onda epidémica con casos de dengue hemorrágico. Luego de los brotes registrados en 2000, no se han notificado casos de dengue autóctonos en la República Argentina, pero sí se han notificado 6 casos importados de otros países del continente durante 2001. El MSN está fortaleciendo las capacidades de las instituciones provinciales a través de programas de entrenamiento para el monitoreo, control y prevención del dengue. Específicamente VIGI+A financiará en parte la instalación de 52 unidades centinelas seleccionadas sobre la base de mapeos de riesgo, prevalencia, densidad del vector y población. Estas unidades vigilarán síndromes febriles a través de pruebas de laboratorio en casos sospechosos y monitoreo del vector en áreas de alto riesgo con alto grado de infestación. Recientemente, se ha elaborado un plan para el control de la enfermedad que será implementado en Paraguay y Brasil.
FIEBRE HEMORRAGICA ARGENTINA
(FHA)
Los arenavirus sudamericanos, transmitidos por roedores, proporcionan
un claro ejemplo de cómo la explotación de nuevas áreas
para el asentamiento humano y la agricultura, han aumentado las probabilidades
para que surjan nuevas enfermedades infecciosas. La fiebre hemorrágica
Argentina es una enfermedad viral aguda grave causada por el arena virus
Junín. Fue detectada por primera vez, en 1958, en las zonas agrícolas
pampeanas con un área de 16.000 km2 desde donde se ha diseminado
y actualmente afecta la región de La Pampa húmeda con
una región endémica de 150.000 Km2 (10 veces el área
inicial) con una población en riesgo de 5.000.000 de habitantes
e infecta cientos de personas por año22, 23. Desde 1997 al 2001
se notificaron una gran cantidad de casos anualmente (Figura 3). Su
principal reservorio es el Calomys musculinus y su distribución
supera el área endémica. El origen del virus y su propagación
son desconocidos. La alta tasa de mortalidad inicial se vio reducida
por la disponibilidad de la vacuna24, 25, cuyo desarrollo tiene una
larga historia26. En una primera etapa (1968-1969), una vacuna con virus
vivos atenuados clonados "XJ Clon 3" fue desarrollada en la
Facultad de Medicina de la Universidad de Buenos Aires, y probada con
resultados satisfactorios en 643 voluntarios. En una segunda etapa con
un clon del virus Junín se desarrolló la vacuna "Candid
1" a través de un proyecto cooperativo entre USAMRIID-OPS-MSN.
Entre 1985 y 1990, un ensayo clínico que incluyó más
de 7.000 voluntarios estableció la immunogenicidad, inocuidad,
y eficacia (95.5%) de la vacuna Candid 1.

A pesar de las condiciones para el ensayo, administración voluntaria, experimental, restricción geográfica y consentimiento informado la vacuna fue ampliamente aceptada por la población23,24. Candid 1 es altamente efectiva, con una protección por anticuerpos de 9 años en aproximadamente el 90% de la población vacunada con una sola dosis. Desde la introducción de la vacuna en 1992 muy pocos casos de FHA han sido notificados y/o confirmados (Figura 3). Sin embargo, es necesario recordar que la FHA no es una enfermedad erradicable, y que a pesar de la buena cobertura de la vacuna, casos aislados y/o brotes pueden ocurrir en el futuro. Por todo esto, la vigilancia destinada a la detección de casos clínicos y la actividad del virus Junín en los roedores deben mantenerse y fortalecerse. Los actuales problemas no deberían interferir en el desarrollo de vacunas, INVEH-ANLIS tiene la tecnología necesaria, pero aún así faltan recursos.
HIV / SIDA
La prevalencia de HIV y SIDA ha mostrado cambios desde que se detectaron
los primeros casos en los '80. La población afectada por hemofilia,
que es nucleada por uno de los Institutos de la Academia y la Fundación
de Hemofílicos, indica que desde 1982 a 1985, 211 de 1.700 (12.4%)
hemofílicos testeados estaban infectados y de éstos, 22/200
(11%) parejas infectaron a su pareja y un recién nacido fue seropositivo
para HIV. De esta población HIV/SIDA, 89 aún están
vivos3, 27.
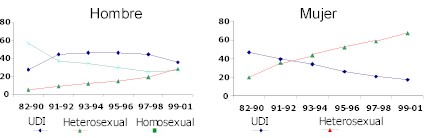
De acuerdo a un modelo matemático reportado en 1992, la transmisión prevalecía en el grupo de homosexual/bisexual28, pero predominaría en el grupo de usuarios de drogas intravenosas (UDI). Hasta septiembre de 2001, un total de 20.713 casos de SIDA habían sido notificados (Tabla 4): la tasa más alta de transmisión corresponde a los UDI (38%), la transmisión en hombres tiende a disminuir, tanto en homosexuales como en UDI, mientras que aumenta en los heterosexuales. En las mujeres ha habido una disminución en el grupo de UDI y un aumento en la transmisión heterosexual, a menudo con una pareja UDI (Figura 4 y Tabla 5). No existen dudas que aún se necesitan programas que ayuden a combatir y prevenir esta enfermedad, sin embargo se destaca que Argentina es uno de los pocos países latinoamericanos que ha implementado leyes para el tratamiento de pacientes con drogas apropiadas.
TUBERCULOSIS (TB)
La tuberculosis (TB) es una enfermedad infecciosa cuyo agente es el
Micobacterium tuberculosis y más raramente por el M. bovis y
el M. africanum. A pesar de ser una enfermedad de diagnóstico
sencillo y tratamiento eficaz, constituye un importante problema de
salud pública como causa mayor de incapacidad y muerte. En Argentina
el promedio de la tasa de notificación anual es inferior a la
de países de la región como Bolivia o Perú, pero
es 3 veces superior a la de Cuba y 5 veces más alta que la notificada
por EE.UU.29.
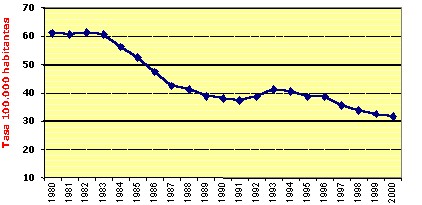
Desde 1982, el número
de casos notificados anualmente en el país, ha experimentado
un descenso continuo, sin embargo esta disminución entre 1999
y 2000 fue mucho menor (2.1%) a lo observado entre 1998 y 1999 (4.4%)
(Figura 5). Esto refleja una reducción de la tendencia al descenso
y, por lo tanto, advierte sobre la necesidad de fortalecer las acciones
de control. A su vez, la situación también es diferente
si se analiza por provincia: durante el año 2000, 8 jurisdicciones
(Jujuy, Salta, Formosa, Chaco, Santa Cruz, Corrientes, Buenos Aires
y Entre Ríos) presentaron tasas superiores al promedio del país,
esto se jerarquiza si sabemos que en estas provincias se concentra el
70% de los casos del país. Algunos distritos de la provincia
de Buenos Aires se constituyen de por sí en un serio problema
de la salud pública30.
En el año 2000, a través del sistema de notificación
de TBC del país, se han notificado 11.767 casos nuevos de Tuberculosis,
de todas las formas y para todas las edades. Esto, en continuidad con
lo observado desde 1993, significa un nuevo descenso de 104 casos respecto
de la cantidad notificada en 1999. No obstante esta continuidad del
descenso en el número de casos notificados, es importante mencionar
que la disminución entre 1999 y 2000 es mucho menor que la observada
entre 1998 y 1999: mientras que entre 1999-2000 la reducción
fue de 104 casos o del 0,8%, en el bienio 1998-1999, el descenso fue
de 405 casos o de un 3,7%. Esto refleja una reducción de la tendencia
al descenso y, por lo tanto, advierte sobre la necesidad de fortalecer
las acciones de control29.
La tuberculosis, además, es uno de los temas de salud más importantes a nivel mundial, por las implicaciones, especialmente drásticas, para países con gran prevalencia del VIH/SIDA. Las personas infectadas por el HIV tienen una posibilidad entre 30 a 50 veces mayor de desarrollar la tuberculosis que aquellos que no están infectados por el VIH. Entre 1992 y 1993 se notificó la existencia de un brote debido a tuberculosis resistente al tratamiento (TB-MR) en pacientes HIV/SIDA internados en hospitales de Rosario y Buenos Aires. La transmisión nosocomial fue controlada a través de medidas de bioseguridad y de tratamiento31.
A pesar de los esfuerzos que desde el Programa Nacional y VIGI+A se están haciendo para fortalecer las capacidades de control y prevención de la enfermad, la administración de tuberculostáticos a los pacientes es crucial. La crisis económica ha puesto en riesgo este aspecto del programa.
LEISHMANIOSIS
Es una enfermedad polimorfa de la piel y de las membranas mucosas causada
por protozoarios pertenecientes a especies del género Leishmania.
En Argentina, el agente infeccioso implicado en los brotes epidémicos
registrados en el norte del país pertenece a los complejos de
especies de L. braziliensis y produce la llamada "leishmaniasis
tegumentaria americana".

Los primeros casos en la
Argentina datan de 1926 y fueron estudiados por Salvador Mazza. Casi
60 años después, la tala indiscriminada de árboles
en el monte chaqueño trajo aparejado la ocurrencia de un brote
de leishmaniasis en Salta en 1985 sobre la Ruta Nacional 34. Comienza
en Pichanal y se extiende por General Mosconi, General Ballivián,
Embarcación, Colonia Santa Rosa y Orán.
A partir de allí, queda definida una zona endémica con
pequeños brotes epidémicos en el norte del país
afectando las provincias de Salta, Jujuy, Tucumán, Catamarca,
Formosa, Misiones, Chaco, Santiago del Estero y Corrientes. La notificación
promedio anual, hasta 1997, alcanzaba a 180 casos. A un nuevo desmonte
de 12 mil hectáreas en Paraje Porcelana (San Martín, Salta)
se asoció el aumento significativo de los casos en 1998 afectando
a más de 900 personas sólo en la provincia de Salta, y
superando los 1.200 casos en el país32 (Figura 6).
Después de los '80, la capacidad de diagnóstico del sistema mejoró junto con la concientización de la población en riesgo. El diagnóstico y tratamiento temprano ha reducido significativamente la incidencia de la enfermedad. Estudios basados en modelos matemáticos y realizados por el CeNDIE-ANLIS facilitan el diseño de estrategias de vigilancia y control de la enfermedad. Estos esfuerzos deben acompañarse de mayor asistencia financiera por parte del MNS.
CONCLUSIONES
La crisis económica reciente ha puesto en evidencia la necesidad
de fortalecer nuestro sistema de vigilancia con perspectivas epidemiológicas
y de laboratorio, y transformarlo en un sistema de vigilancia de la
salud pública, definida como el proceso dirigido a identificar
en forma sistemática los determinantes y los cambios del estado
de salud de la población a través del tiempo, proporcionando
conocimientos científicamente fundamentados como insumo para
planificar y poner en práctica un sistema de salud (promoción,
prevención, tratamiento y rehabilitación), así
como para evaluarlo en términos de eficacia, eficiencia y efectividad.
Las enfermedades emergentes y reemergentes deben ser entendidas en un
contexto de emergencia sanitaria, en el que la desnutrición,
la pobreza, el desempleo e inequidades favorecen su aparición
y propagación. Hoy el esfuerzo debe ser mayor y convocar a todos
los sectores para poder controlar la emergencia.
AGRADECIMIENTOS
Agradecemos a todos los investigadores quienes han contribuido con datos
y opiniones, y felicitamos sus esfuerzos para resolver las dificultades
y continuar investigando aún con las adversidades.
Marcelo Bortman, (VIGI+A); Delia Enría, (INEVH-ANLIS); Hugo Fernández,
(VIGI+A); Isabel Kantor, (TB-WHO); Paula Padula, (INEI-ANLIS); Adriana
Procupet, (LUSIDA); Marta Rivas, (INEI-ANLIS); Daniel Salomón,
(CeNDIE-ANLIS); Elsa Segura, (CeNDIE-ANLIS); Mercedes Weissenbacher,
(CNRS).
ABREVIATURAS Y SIGLAS
WHO World Health Organization.
PAHO Pan-American Health Organization.
CDC Centers for Disease Control and Prevention.
IUATLD International Union Against Tuberculosis and Lung Diseases.
MSN Ministerio de Salud de la Nación.
Vigi+A Programa de Vigilancia de la Salud y Control de Enfermedades.
ANLIS Administración Nacional de Laboratorios e Institutos de
Salud.
INEI-ANLIS Instituto Nacional de Enfermedades Infecciosas (Malbrán).
INEVH-ANLIS Instituto Nacional de Enfermedades Virales (Maiztegui).
INER-ANLIS Instituto Nacional de Enfermedades Respiratorias (Coni).
CeNDIE-ANLIS Centro de Investigaciones Epidemiológicas.
LUSIDA Programa Nacional de Lucha contra Retrovirus y SIDA.
CNRS Centro Nacional de Referencia de SIDA.
REFERENCIAS
Intencionalmente, la mayoría de las referencias son de Medicina (Buenos Aires), una revista indexada con 62 años de ininterrumpida publicación que siempre ha dado prioridad a los reportes de enfermedades emergentes y reemergentes de nuestro país.
http//www.medicinabuenosaires.com E-mail:revmed@intramed.net.ar
Trabajo presentado en la
Sesión Pública Ordinaria de la Academia Nacional de Medicina
el día 3 de junio de 2002.
Centro de Investigaciones Epidemiológicas (CIE), Academia Nacional
de Medicina, Buenos Aires, Argentina & Programa Vigi A, Ministerio
de Salud de la Nación, Argentina; *** Programa de Residencia
en Epidemiología de Campo, Universidad de Tucumán &
Programa Vigi A, Ministerio de Salud de la Nación, Argentina;
**** Miembro Titular, Academia Nacional de Medicina de Buenos Aires.
Dción. Postal: Dra. Zulma Ortiz. Pacheco de Melo 3081; 1425-Buenos
Aires, Argentina.
E-mail:cie@epidemiologia.anm.edu.ar
Internet: http//www.epidemiología.anm.edu.ar
BIBLIOGRAFÍA
1. World Health Organization.
Communicable disease prevention and control: new emerging, and re-emerging
infectious diseases. WHO document A48/15, 1995.
2. Public health surveillance and disease control program (VIGI A),
Ministry of Health. In www.direpi.vigia.org.ar/vigia/vigia.htm
3. SIDA y el desafío de las enfermedades emergentes. Simposio
Internacional, Academia Nacional de Medicina, Buenos Aires, setiembre
1998. Medicina (Buenos Aires) 1998; 58(Supl I):1-84.
4. Problemática de la enfermedad de Chagas. Simposio Internacional,
Academia Nacional de Medicina, Buenos Aires, abril 1999. Medicina (Buenos
Aires) 1999; 59 (Supl II):1-128.
5. Síndrome Urémico Hemolítico. Simposio Internacional,
Academia Nacional de Medicina, Buenos Aires, junio 2001. Bol A N de
Medicina 2001; 79:117-53.
6. Gianantonio CA, Vitacco M, Mendilaharzu F. Gallo G, Soljo E. The
hemolytic uremic syndrome. Nephron 1973; 11:174-92.
7. Karmali MA, Steele BT, Petric M, Lim C. Sporadic cases of hemolytic-uremic
syndrome associated with faecal verotoxin and cytotoxin producing Escherichia
coli in stools. Lancet 1983; 1:619-20.
8. Rivas M, Miliwebsky E, Balbi L et al. Intestinal bleeding and occlusion
associated with Shiga toxin-producing Escherichia coli 0127:H21. Medicina
(Buenos Aires) 2000; 80:249-52.
9. Fernández G, Rubel C, Dran G, Gómez S, Isturiz M, Palermo
MS. Shiga toxin-2 induces neutrophilia and neutrophil activation in
a murine model of hemolytic uremic syndrome. Clin Immunol 2000; 95:227-34.
10. Weissenbacher M, Merani M, Hodara V et al. Hantavirus infection
in laboratory and wild rodents in Argentina. Medicina (Buenos Aires)
1990; 50:43-6.
11. Weissenbacher M, Cura E, Segura E et al. Serological evidence of
human hantavirus infection in Argentina, Bolivia and Uruguay. Medicina
(Buenos Aires) 1996; 56:17-22.
12. Duchin J, Koster F, Peters C et al. Hantavirus pulmonary syndrome:
A clinical description of 17 patients with a newly recognized disease.
N Engl. J Med 1994; 330:949-55.
13. Martínez V, Colavecchia S, Garcia Alay M et al. Síndrome
pulmonar por Hantavirus en la provincia de Buenos Aires. Medicina (Buenos
Aires) 2001; 61:147-56.
14. Hart C, Bennett M. Hantavirus infections: epidemiology and pathogenesis.
Microbes and Infection 1999; 1:1229-37.
15. Enria D, Padula P, Segura E et al. Hantavirus pulmonary syndrome
in Argentina. Possibility of person to person transmission. Medicina
(Buenos Aires) 1996; 56:709-11.
16. Padula P, Edelstein A, Miguel S et al. Brote epidémico de
síndrome pulmonar por hantavirus (SPH) en Argentina: evidencia
molecular de la transmisión persona a persona del virus Andes.
Medicina (Buenos Aires) 1998; 58(Supl I): 27-36.
17. Padula P, Colavecchia S, Martínez V et al. Genetic diversity,
distribution and serologic features of hantavirus infection in five
countries of America. J Clin Microbiol 2000; 38:3029-35.
18. Lazaro M, Resa A, Barclay C. Síndrome pulmonar por hantavirus
en el sur andino argentino. Medicina (Buenos Aires) 2000; 60:289-301.
19. Martínez Torre E. Dengue y dengue hemorrágico. 1998,
Buenos Aires, Editorial de la Universidad Nacional de Quilmes.
20. Avilés G, Rangeon G, Baroni P et al. Epidemia por virus Dengue-2
en Salta, Argentina, 1998. Medicina (Buenos Aires) 2000; 60:875-9.
21. Seijo A, Cernigoi B, Deodato B. Dengue importado del Paraguay a
Buenos Aires, estudio clínico y epidemiológico de 38 casos.
Medicina (Buenos Aires) 2001; 61:137-41.
22. Maiztegui J, Sabattini M. Extensión progresiva del área
endémica de fiebre hemorrágica, Argentina. Medicina (Buenos
Aires) 1977; 37:162-66.
23. Enria D, Briggiler A, Feuillade M. An overview of the epidemiological,
ecological and preventive hallmarks of Argentine haemorrhagic fever
(Junin virus). Bull Inst Pasteur Paris 1998; 96:103-14.
24. Maiztegui J, Fernández N, Damilano A. Efficacy of immune
plasma in treatment of Argentine Hemorrhagic Fever and association between
treatment and late neurological syndrome. Lancet 1979; 2:1216-7.
25. Enria D, Briggliler A, Fernández N, Levis S, Maiztegui J.
Importance of dose of neutralizing antibodies in treatment of Argentine
haemorrhagic fever with immune plasma. Lancet 1984; 2:255-6.
26. Weissenbacher MC, Laguens RP, Coto CE. Argentine Hemorrhagic Fever.
Curr Topics Microbiol & Immunol 1987; 134:79-116.
27. Tezanos Pinto M. El impacto de la infección por HIV en la
población hemofílica. Medicina (Buenos Aires) 1998; 58(Supl
I):45-8.
28. Raggi R, Blanco GA. Epidemic model of HIV infection and AIDS in
Argentina. Status in 1990 and predictive estimates. Medicina (Buenos
Aires) 1992; 52:225-35.
29. Programa Nacional de Tuberculosis. Instituto Nacional de Enfermedades
Respiratorias, 2000.
30. Chirico C, Kuriger A, Fernández H, Morcillo N. Tuberculosis
en la Región Sanitaria V de la provincia de Buenos Aires. Análisis
de su tendencia entre 1984 y 1996. Medicina (Buenos Aires) 1999; 59:332-8.
31. Kantor IN, Latini O, Barrera L. La resistencia y multirresistencia
a los medicamentos antituberculosos en Argentina y en otros países
de América Latina. Medicina (Buenos Aires) 1988; 58:202-8.
32. Sosa Estani S, Segura E, Salomón O et al. Tegumentary leishmaniasis
in Northern Argentina: distribution of infection and disease, in three
municipalities of Salta, 1990-1992. Rev Soc Bras Med Trop 2000; 33:573-82.